УДК 615.849.19
Влияние пространственной структуры лазерного излучения на эффективность лазерной биостимуляции
Саляев Р.К., Сибирский институт физиологии и биохимии растений СО РАН (СИФИБР), директор, чл.-корр. РАН, (Иркутск)
Дударева Л.В., СИФИБР, н.с., (Иркутск)
Ланкевич С.В., СИФИБР, н.с., (Иркутск)
Выговский Ю.Н., к.ф.-м.н., Генеральный директор ООО МТО “МеДиа”, (Москва)
Малов А.Н., Иркутский государственный университет, профессор, д.ф.-м.н., (Иркутск)
Фещенко В.С., Приднестровский государственный университет, зав. лаб., к.ф.-м.н., (Тирасполь)
Выговская Н.Ю., ООО Объединение “ЛИНТАК”, менеджер (Москва)
Дополнительная информация на сайтах
http://www.media-security.ru
http://www.xyz248.ru
Сложное и крайне анизотропное в оптическом отношении строение биологических объектов, имеющих квазижидкокристаллическую компоненту и содержащих связанную структурированную воду, обуславливает широкое многообразие оптических явлений при распространении в них лазерного излучения. Излучение может распространяться в живой ткани в волноводном режиме, претерпевать значительную дифракцию на неоднородностях, образуя различные каустики и интерференционные картины в толще ткани, что способствует значительной концентрации излучения и стимуляции фотобиохимических реакций.
В настоящей работе с целью определения особенностей структуры поля процесс дифракции светового излучения на клеточных структурах рассматривается в рамках традиционного квазиоптического подхода [1, 2] без учета случайной составляющей рассеяния, приводящей к образованию спекл-структур и в среднем описывающейся статистическими методами. Само явление лазерной биостимуляции предполагается известным [3 – 5 ].
Теоретический анализ процессов дифракции в клеточных структурах.
При взаимодействии лазерного излучения инфракрасного и видимого диапазона с биологическими клеточными структурами, имеющими характерный размер регулярной неоднородности - линейный размер клетки - d от 100 до 1 мкм, можно выделить две характерные области: квазиоптическую (d>
>
l
) и резонансную (d~
l
). В резонансной области существенную роль играют так называемые собственные электромагнитные колебания, возбуждаемые в объеме неоднородности (клетке) падающей волной [1]. Поскольку каждому конечному физическому телу присущ свой дискретный набор собственных колебаний (мод), то основной вклад в рассеянное поле, распространяющееся далее в глубь биоткани, дает излучение той колебательной моды клетки, частота, поляризация и пространственная форма которой ближе к таковым для падающей волны. Учитывая, что система клеток многослойна, можно сделать вывод, что после прохождения через достаточно большое число слоев асимптотически установится распределение интенсивности изучения, соответствующее “усредненным” параметрам клетки. Иными словами, можно сказать, что имеются резонансные условия для прохождения монохроматического излучения через клеточную структуру. Этот процесс можно трактовать и как “самоподстройку” характеристик падающего излучения под оптические свойства системы, поскольку наибольшее пропускание имеет место для пространственно-временных мод, содержащихся в падающей волне и соответствующих наинизшей моде элементарной составляющей структуры - клетки.
В квазиоптической области (d>
>
l
) основное влияние оказывают локальные неоднородности структуры, т.е. границы клеток. При этом считается, что относительный вклад мод колебаний отдельной неоднородности достаточно мал. В этом случае дифракционные явления в окрестностях каустик, фокусов и в зоне полутени учитываются как эффект диффузии лучевой амплитуды в смежные лучевые трубки, т.е. по волновым фронтам распространяющегося излучения [1, 2].
Клеточную структуру в радиофизическом смысле можно рассматривать как систему, в которой происходит направляемый волновой процесс или канализация оптического излучения. В отличие от известных направляющих систем, имеющих продольную однородность или периодическую неоднородность [1, 6, 7], клеточная структура имеет и поперечную и продольную периодические неоднородности. Далее рассматривается только распространяющееся вглубь структуры излучение, без учета рассеяния, переотражения и поглощения (т.е. анализируется чисто фазовая система), не учитываются временные изменения клеточной структуры, имеющие место в реальной биоткани. Параметры элементарной ячейки клеточной структуры и обозначения параметров задачи приведены на рис. 1. Внутри ячейки показатель преломления есть функция поперечных и продольных координат n(x,z). В установившемся режиме распространения когерентного излучения в клеточной структуре, поскольку рассматриваемая ячейка находится среди таких же ячеек, должно выполняться соотношение:
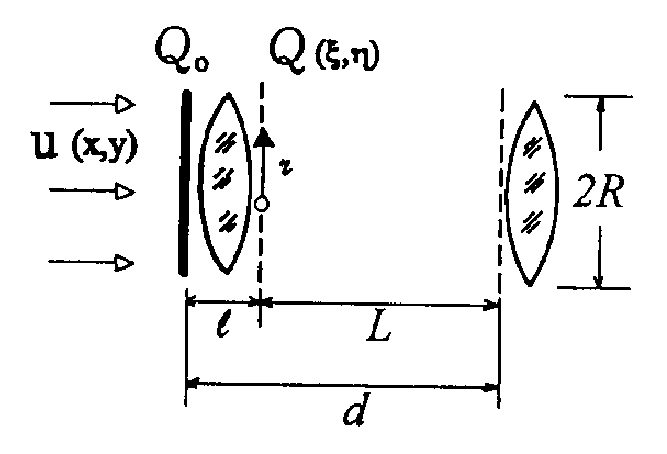 Рис. 1. Параметры элементарной ячейки клеточной структуры.
Рис. 1. Параметры элементарной ячейки клеточной структуры.
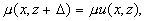 (1)
(1)
где m
- не превосходящий единицы вещественный множитель. Условие (1) соответствует продольной периодичности структуры поля и приводит к выражению [1,2]:
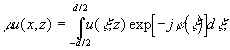 (2)
(2)
где
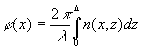 (3)
(3)
- функция фазовой коррекции волнового фронта, осуществляемая элементарной ячейкой; l
- длина волны излучения. Уравнение (2) представляет собой известное [1] однородное интегральное уравнение Фредгольма второго рода и имеет счетную последовательность собственных значений {m
n} и соответствующую ему совокупность собственных функций (мод) {un(x)}. Основной моде с n=0 отвечает наиболее узкий пучок лучей [2], имеющий минимальные энергетические потери (m
0³
m
1³
...). Поскольку рассматривается установившийся режим распространения излучения в клеточной структуре, то основную роль играет эта основная мода, и на уровне ячейки можно учитывать только параксиальные пучки. Физически это следует из подобия по своим резонансным характеристикам линзовой или диафрагменной линии открытому резонатору[1,2]. В терминах теории степеней свободы[8] это означает, что элементарная ячейка клеточной структуры имеет одну моду или две степени свободы (при когерентном освещении). Обычно нулевую моду можно апроксимировать функцией Гаусса.
С практической точки зрения из сказанного следует вывод о том, что для максимизации световой энергии, поступающей вглубь биоткани, освещение следует производить лазерным пучком, параллельным оптической оси клеточной структуры (перпендикулярно слоям клеточной структуры).
Поскольку в уравнение (2) как параметр входит и длина волны l
, то структура результирующего поля зависит от соотношения между величиной l
и параметрами клеточной структуры d и D
. Другими словами, взаимодействие монохроматического излучения с клеточной структурой должно иметь резонансный по l
характер, поскольку длина волны является параметром установившейся моды u0(x) излучения, распространяющегося вглубь биоткани. В реальных биологических структурах мода uo(x,y), если облучение проводится плоским волновым фронтом, формируется первым по ходу излучения слоем клеток из-за сильной оптической неоднородности последних. Очевидно, что оптимальным в смысле максимизации световой энергии, попадающей вглубь клеточной структуры, является освещение первого слоя клеток коллимированым вдоль оптической оси линзовой линии когерентным излучением с плоским волновым фронтом.
Модовый характер распространения излучения в биологической клеточной системе позволяет рассматривать живую ткань как волноводную среду с характерным квантованием значений постоянной распространения по всем трем координатным осям, и определить моды как устойчивые при распространении в такой среде волновые поля [2, 8]. Моды не расплываются и не изменяют пространственной структуры в процессе распространения в своей среде, а лишь приобретают фазовый набег, пропорциональный пройденному расстоянию.
После того, как излучение прошло несколько слоев клеток и режим принял установившийся характер, то устойчивость структуры моды u0(x) имеет место при любом пройденном излучением расстоянии. Поэтому, если облучается участок размером (2M+1)´
(2N+1) клеток, где M,N>>1, то установившийся волновой фронт можно записать для случая двух изменений в следующем виде (рис.2):
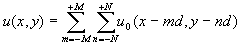 (4)
(4)
где элементарная мода u0(x,y) определяется либо как собственная функция уравнения, аналогично уравнению (2) если d>>l
, либо как распределение поля, соответствующее моде собственных колебаний отдельной клетки при d~
l
[6, 7, 9].
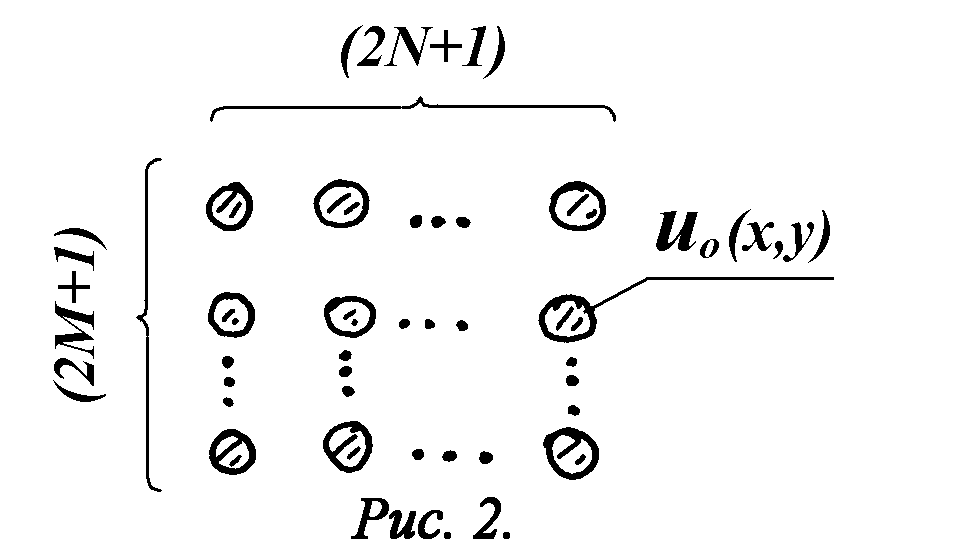
Рис.2. Схема структуры установившегося волнового фронта в клеточной структуре.
Для биостимуляции живой ткани лазерным излучением, независимо от предположений о первичной фотохимической реакции, необходимо, чтобы тонкая пространственная структура поля соответствовала клеточной структуре. “Резонанс” этих двух структур требует максимального контраста в распределении интенсивности световой волны, что достигается за счет высокой монохроматичности и пространственной когерентности падающего лазерного излучения.
Для обеспечения максимального согласования всего поля, состоящего из элементарных мод u0, с облучаемой биоструктурой, которое реализуется за счет селекции мод в клеточных “линзовых” или “диафрагменных” линиях, желательно проводить одновременное облучение всего массива (2M+1)´
(2N+1) клеток. Действительно, если облучение клеточной структуры осуществляется сканирующим лазерным лучом, то распределение интенсивности вместо квадрата модуля выражения (4) примет вид: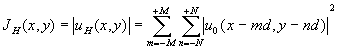 (5)
(5)
и биостимуляция каждой клетки будет происходить независимо от других, хотя по смыслу биологических явлений они функционируют, конечно, согласованно. В случае же одновременного освещения всего (2M+1)´
(2N+1) массива клеток распределение интенсивности имеет вид:
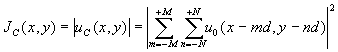 (6)
(6)
и содержит в правой части интерференционные слагаемые, что делает поле (6) более структурно разнообразным по сравнению с (5).
Если использовать для оценки сложности структуры поля концепцию степеней свободы оптического изображения [8], где под общим числом степеней свободы поля понимается общее количество действительных величин, необходимых для его полного описания, то видно, что для описания поля (5) необходимо (2M+1)´
(2N+1) действительных величин, а для описания поля (6) - вдвое больше из-за комплексного характера членов ряда, находящегося целиком под знаком модуля.
Поперечная периодичность поля излучения, прошедшего через клеточную структуру, приводит к возникновению продольной (вдоль направления распространения) его периодичности. В традиционной оптике подобные процессы известны как явления саморепродукции или самоизображения структуры светового поля и классифицируются как эффект Лауэ (для некогерентного освещения) и эффект Тальбота (для когерентного освещения)[10 - 12]. Малая интенсивность некогерентных источников света позволяет не учитывать эффект Лауэ при анализе процессов распространения света в биотканях и ограничивается феноменологическим описанием в рамках закона Бугера. Иначе обстоит дело в случае лазерных источников света, обеспечивающих высокую интенсивность монохроматического пространственно-когерентного освещения. При анализе эффекта Тальбота[10-12] обычно рассматривают объекты типа одной или нескольких дифракционных решеток. В случае биоткани, очевидно, ситуация оказывается более сложной. Тем не менее, результаты теоретических и экспериментальных исследований процессов дифракции когерентного излучения на периодических структурах для целей мультипликации изображений[10] и бесконтактной метрологии[11] могут быть использованы в качестве исходных для уяснения примерной структуры поля в биосистемах с клетоным строением.
При освещении дифракционной решетки с периодом d когерентным излучением с длиной волны l
поперечное периодическое распределение интенсивности света на объекте самоизображается (саморепродуцируется) вдоль направления распространения излучения, причем плоскости точного самоизображения - плоскости Тальбота - находятся на расстояниях, кратных
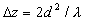 , (7)
, (7)
от плоскости периодического объекта. На полпути между этими плоскостями интенсивность света также воспроизводит первоначальное изображение, но оно сдвинуто по поперечной координате на полпериода. Поскольку такой сдвиг в большинстве случаев несущественен, то можно считать, что изображения Тальбота наблюдаюся на расстояниях
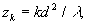 k=1,2,... (8)
k=1,2,... (8)
от плоскости объекта. Поскольку явление саморепродукции связано с интерференцией когерентных пучков, дифрагировавших на предмете, то число реально наблюдаемых плоскостей Тальбота существенно зависит от размера его апертуры.
Эксперименты по биологической стимуляции модулированным лазерным излучением.
Первые эксперименты по лазерной биостимуляции культур тканей проводились нами совместно с О.О.Тиминой на образцах баклажанов и перцев[13]. В экспериментах использовались растения линии Л-229, относящиеся к виду Solanum melongena L., Западно-азиатского подвида (ssp.occidentale Has.), а также линии Л - 271, Южно-азиатского подвида (ssp.meridionale Fil) и гибрида F1 Л-271 х Л-229. Растения выращивались в контролируемых условиях среды: фотопериод 16 часов, t=25+2 C, освещенность 3500- 4000 лк на среде Мурасиге и Скуга без гормональных добавок. Предварительно семена обрабатывались 15% хлорной известью в течение 20 минут с последующей пятикратной промывкой стерильной дистиллированной водой. Влияние физиологического состояния изучали на части этих же растений, перенесенных в холодную камеру для выращивания: t=15-18 C, фотопериод 12 часов, освещенность 3000-3500 лк. В экспериментах использовались экспланты (5 - 7 мм) гипокотиля), семядолей, черешков семядолей и настоящего листа, стебля и апекса в возрасте 10,25 и 75 дней от даты массовых всходов растений. Повторность в опыте от 5 до 20 эксплантов на вариант. В опытах регистрировали динамику образования соматических эмбриоидов в зависимости от воздействующего фактора. Гибридизацию проводили традиционным методом с изоляцией. Гибридность F1 проверяли по доминантному маркерному признаку - наличию антоциановой окраски гипокотиля.
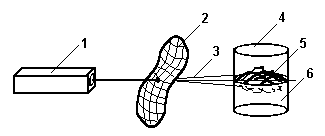
Рис.3. Оптическая схема для биологической стимуляции культуры клеток. 1 -лазер, 2 - лист модулирующий электромагнитное излучение, 3 - модулированное лазерное излучение, 4 - стеклянная колба, 5 - культура клеток, 6 - питательная среда.
Эксперимент проводился по следующей схеме (рис 3). Культуру клеток растения облучали через лист другого растения неразведенным лучом гелий-неонового лазера. Мощность излучения после прохождения через лист была 0,1 мВт. Лист брался у растения, стимулируемый признак у которого проявлялся и без облучения. Контролируемым признаком была способность культуры клеток растения к образованию полноценных соматических эмбриоидов.
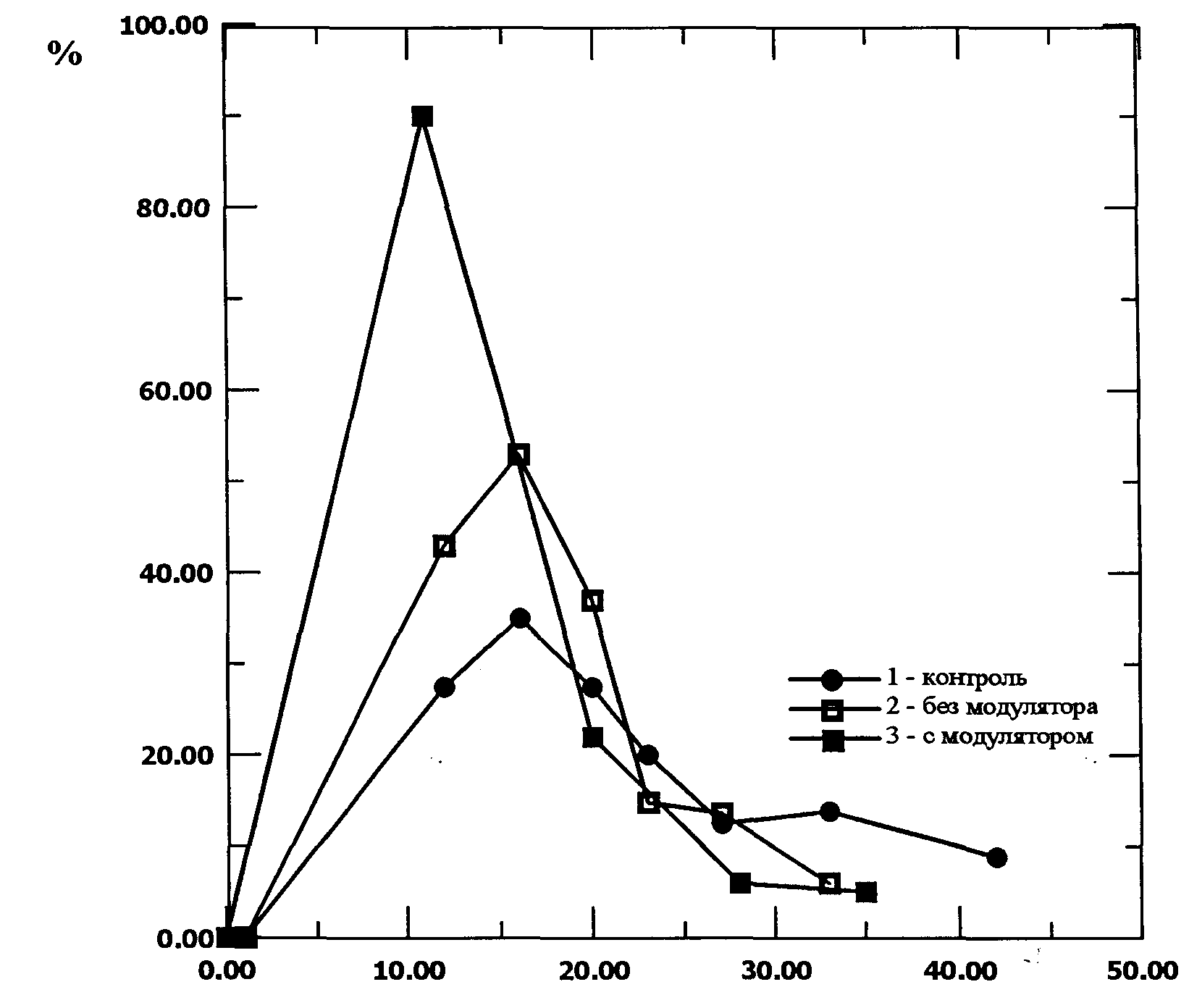
Оказалось, что воздействие модулированного лазерного излучения на экспланты баклажана направленно изменяет характер экспрессии признака: оптимальная экспозиция способствует повышению ее уровня как у неотзывчивых, так и отзывчивых эксплантов. У каллусной культуры перца ни одна из экспозиций не вызвала направленного изменения в экспрессии в сравнении с контролем. Отсутствие экспрессии у данной линии перца скорее свидетельствует об изначальной генетической неспособности к формированию соматических эмбриоидов этим генотипом, поэтому и воздействующий фактор не смог изменить его норму реакции. Усиление экспрессии, особенно в случае неотзывчивых эксплантов, может явиться интересным практическим применением выявленного факта. Результаты экспериментов отображены на графиках представленных на рис. 4.
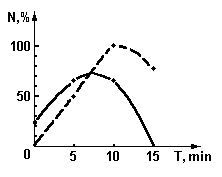
Рис. 4. График зависимости количества образовавшихся зародышей от времени экспозиции излучением гелий-неонового лазера, модулированного листом растения.
¾
¾
- для гипокотиля, - - - - - - для тканей стебля.
На графиках зависимости количества образующихся зародышей от времени экспозиции, представленных на рис. 4, наблюдаются экстремумы. Так для тканей каллуса экспозиция более 15 мин привела, по-видимому, к подавлению или полной пассивации процесса формирования зародышей. Кроме того, как видно из графиков, при модулированном облучении культуры клеток полученных из стебля, контролируемый признак проявился. В тоже время без облучения или при облучении немодулированным излучением эта культура ткани вообще не формирует зародышей растений.
Лазерная биостимуляция тканей пшеницы.
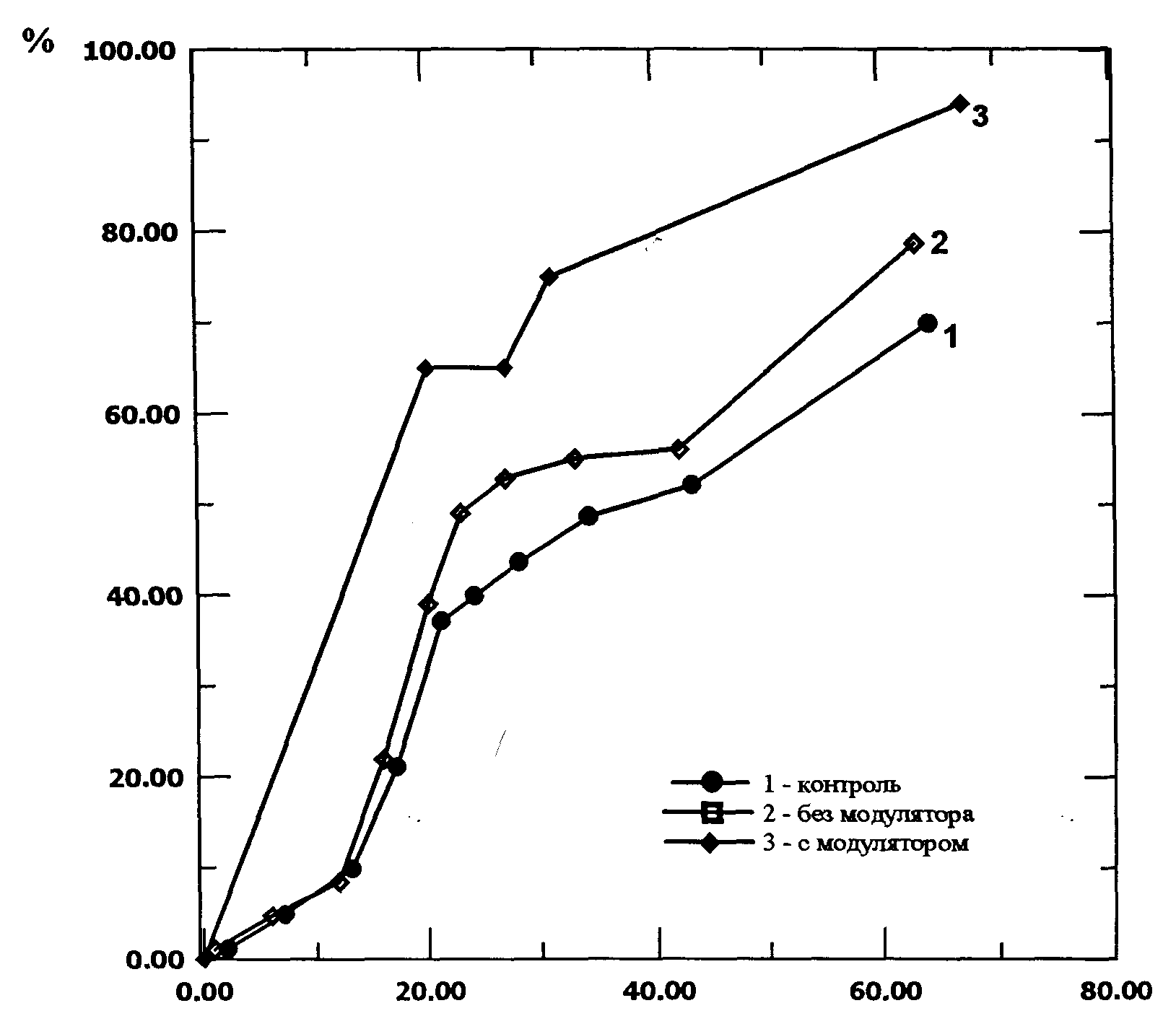
В качестве объекта исследования была выбрана культура тканей пшеницы, полученная из усеченных зрелых зерновок пшеницы сорта Скала. Зародыши с половинкой эндосперма помещали на питательную среду. ( Индукцию каллусогенеза проводили на среде Мурасиги-Скугэ с добавлением 2 мг. 2,4-D и 2%-ной сахарозы). Источником низкоинтенсивного когерентного излучения служил гелий-неоновый лазер с интенсивностью15 мВт на объекте в опытах с немодулированным излучением, и от 6 до 12 мВт в опытах с пространственной модуляцией излучения. Определяли число морфогенных зон и динамику корнеобразования, как параметры культуры ткани, характеризующие ее рост и развитие. Указанные параметры регистрировались для 100 каллусов во всех трех вариантах опыта: а) обычное лазерное излучение, б) модулированное излучение, в) контроль. Контролем служили необлученные каллусы. Достоверность различия сравниваемых значений оценивали с помощью t-критерия. Изучена динамика корнеобразования в растущей каллусной культуре пшеницы под влиянием модулированного (модулятором служил лист томата, выбранный более чем из 30 растений по соображениям наименьших потерь энергии) и немодулированного лазерного излучения (рис. 5).
Установлено, что в образцах, облученных модулированным излучением, ризогенез достигал 93%, в то время как в опыте с обычным лазерным излучением число каллусов, образовавших корни, не превышало 80%, а в контроле 70%. Еще одним исследуемым параметром служило количество морфогенных зон (рис. 6). В начале опыта число морфогенных зон в образцах облученных модулированным лазерным светом значительно (90% против 40% и 50%) превышает соответствующее их количество и в контроле и в опыте с немодулированным излучением. Затем этот показатель выравнивается, что, вероятно, связано с интенсивным корнеобразованием в этих образцах.
Время культивирования(дни)
Рис. 5 Влияние модулированного и немодулированного лазерного излучения на корнеобразование в каллусной культуре пшеницы (сорт Скала)
время культивирования(дни)
Рис 6. Влияние модулированного и немодулированного лазерного излучения на количество морфогенных зон в каллусной культуре пшеницы (сорт Скала)
Заключение.
Теоретически обосновано и впервые экспериментально исследовано явление стимуляции пространственно модулированным лазерным излучением процесса дифференциации растительных тканей. Пространственная модуляция лазерного излучения при этом должна соответствовать конкретному типу растения, а наибольший эффект достигается при освещении недифференцированных участков ткани излучением, прошедшим через лист подобного растения. Таким образом, эксперименты подтверждают, выдвинутые в [7,9], предположения о влияниях электромагнитного поля на эффективность лазерной биостимуляции при условии согласования структуры поля со структурой биологического объекта.
- Ваганов Р.Б., Каценеленбаум Б.З. Основы теории дифракции. - М.: Наука. - 1982. - 272 с.
- Солимено С., Крозиньяни Б., Ди Порто П. Дифракция и волноводное распространение оптического излучения. - М.: Мир. - 1989.- 664 с.
- Кару Т.И. Фотобиология низкоинтенсивной лазерной терапии./ Итоги науки и техники, серия физ. основы лазер. и пучков. технол.//ВИНИТИ. - 1989. - 4 - с.44-84.
- Илларионов В.Е. Основы лазерной терапии. - М.: РЕСПЕКТ - 1992 - 122 с.
- Девятков Н.Д., Голант М.Б., Бецкий О.В. Миллиметровые волны и их роль в процессах жизнедеятельности. - М.: Радио и связь. - 1991. - 168 с.
- Малов А.Н.,Малов С.Н., Черный В.В. Лазерная биостимуляция как самоорганизующийся неравновесный процесс / Тезисы IV Межд. Конгресса “Проблемы лазерной медицины” - Москва-Видное, 1997, с.278-279.
- Malov A.N., Malov S.N., Festchenko V.S. Resonance nature of laser biostimulation from the point of view of quasi-optics. //Laser Physics. - 1996 -v.6, N 5 - p.979-982.
- Malov A.N. Control over information characteristics of coherent optical systems. // Laser Physics. - 1993 -v.3, N 1 - p. 193-203.
- Малов А.Н., Малов С.Н., Черный В.В. Физические основы лазерной терапии. \ Иркутск: ИФ ИЛФ СО РАН, 1997. – препринт № 2. –46 с.
- Patorsky K. The self-imaging phenomenon and its application // In “Progress in Optics” /Ed. E.Wolf. - Elsevier Publ., New York, - 1989 - v.27 - p.3-108.
- Kalestynski A., Smolinska B. Self-restoration and the autoidolon of defective periodic objects // Optica Acta. - 1978 - v.25, N 2 - p. 125-134.
- Chavel P., Strand T.C. Range measurement using Talbot diffraction imaging of gratings // Applied Optics. - 1984. - v.23, N 6. - p.862-871.
- Тимина О.О., Малов А.Н., Фещенко В.С. Эмиссия признака соматический эмбриодогенез у баклажана. \\ “Международный симпозиум по селекции и семеноводству овощных культур”, РАСХН – М., 1999. С. 354- 359.


